双离子Zn-Cu电解质提升锌离子电容器(ZICs)能量密度
时间: 2024-10-28 21:24:35 | 作者: 新闻动态
器,使它们能够以快充或放电速率提供高能量密度。结合了氧化还原金属负极,类似于电池,以提高电荷存储能力,双电层正极,允许快速动力学和维持高功率密度。第一个金属离子电容器是基于锂和钠离子,但与这些金属相关的潜在安全风险隐患促使人们寻找其他替代品。特别是,锌离子电容器(ZICs)成为一种吸引人的选择,具有环境安全的优势,作为二价体系的高理论容量为820 mAh/g,以及丰富的锌储量不受地理政治学因素影响的影响。然而,锌离子器件由于氧化还原循环的不稳定性和阳极利用率低而受到限制,这大幅度的降低了器件的比能,阻碍了其商业可行性。
(1) 在负极沉积/剥离过程中,电解质中铜离子的加入促进了CuZn合金的沉积;
为了抑制枝晶,实现高负载和利用率。作者设计一种使用锌负极的锌铜双离子电解质,如图1所示。在负极沉积/剥离过程中,电解质中铜离子的加入促进了CuZn合金的沉积。与以前的方法不同,用新沉积的锌来筛选基底表面的合金,这里的CuZn从电解质中补充,以保持对平面晶粒生长。铜离子在电解质中的潜在用途可能被忽视,因为水电解质中有害的氧化铜形成;在这里,选择了非水溶剂来规避氧化物问题。分析了沉积/剥离过电位,揭示了防止负极枝晶形成的机理。使用双离子电解质,由正极的活性炭和负极的电镀锌进行22000次氧化还原循环(相当于557小时),以评估电池的稳定性,并确定电池短路前的累积容量。该器件的高面积容量为0.74 mAh/cm2和更好的平衡n/p比值,以展示其在实际条件下的性能,并允许与目前最先进的金属离子电容器进行比较。
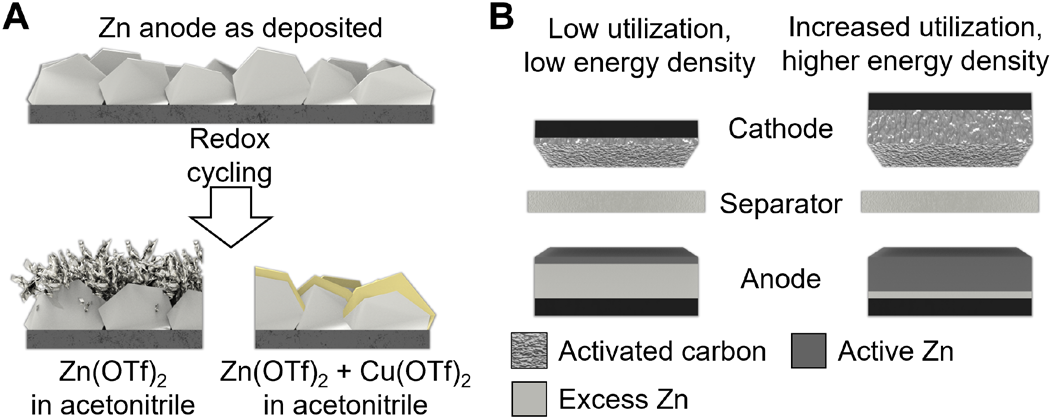
图1. 锌离子器件中枝晶和负极利用率低的问题。(A)使用双离子电解质抑制枝晶形成的概念。(B)通过沉积和剥离更高部分的负极来最小化多余的锌容量,以增加面积能量密度。
图2显示了在25mA/cm2的电流密度下,0到2V的循环下负极观察到的形态和组成的变化。按照方法中的描述制备扣式电池,经过循环后,将电池拆解,对负极进行成像。在任何循环之前,所制备的锌阳极的平均表面粗糙度(Sa)为1.3μm,在三维(3D)光学剖面仪扫描的区域内有几个超过15μm的突出特征。对于含有0.5M Zn(OTf)2电解质的电池,经过1600次循环后,负极粗糙度增加到2.3 μm,由于一些锌枝晶刺穿隔膜,电池短路。同时,对于双离子Zn-Cu电解液[0.5M Zn(OTf)2和0.1M Cu(OTf)2]的电池,经过1600次循环后,负极保持了与图2a初始表面相当的粗糙度。使用锌铜电解质,电池即使在10000次循环后仍继续工作,粗糙度为2.0 μm。
图2B显示了负极在纯锌或锌-铜电解质中循环后的X射线°处有一个主导峰,代表Zn(101)晶体取向。对于在纯锌电解质中进行1000次循环后的负极,衍射模式仍然与初始测量结果相似。而在Zn-Cu电解质中循环1000次后,阳极在36.3°时的峰值略有增加,表明晶体在Zn(002)取向上生长,有利于平面晶粒沉积,如图2c所示。当5000次循环时,在41.8°处出现峰值,与CuZn5合金的掺入相对应。随后在10000次循环中,CuZn5峰超过了Zn(101)峰的强度,表明合金大量参与了长期循环过程。
图2 (D至G)中的扫描电镜(SEM)图像比较了负极表面形态,显示了仅Zn和Zn-Cu电解质中枝晶形成的程度。在仅含锌的电解质中循环1000圈后,图2e中的负极被枝晶覆盖,最初的大颗粒被剥离。在锌铜电解液中循环的负极显示,沉积和镀过程引入了亚毫米级的粗糙度,但1000圈循环后颗粒结构保留,如图2f所示。CuZn合金在负极中被检测到。经过5000次循环后,粒径进一步减小,但图2g中枝晶并不普遍。在10,000次循环中,观察到负极中Cu离子的耗尽。由于电解质中铜的耗尽,对枝晶形成的抑制无效。然而,由于下面的CuZn合金,树突的生长是各向同性的,不太倾向于只垂直向隔膜生长,如图2e所示。因此,使用锌-铜电解质的ZIC在10000次循环中没有短路,并在n/p比为5.93的负极下继续工作高达22000次循环。
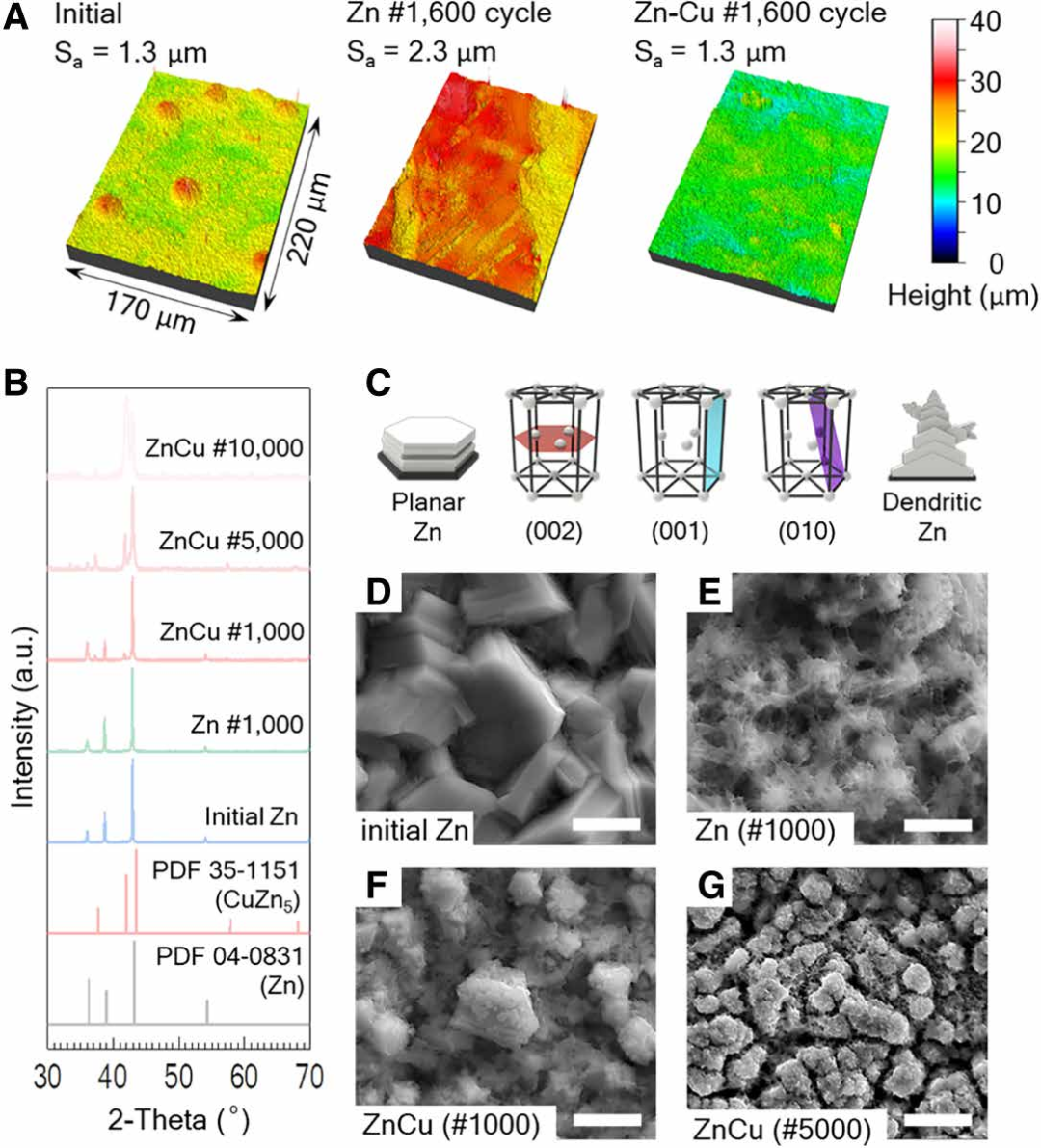
图2. 表面粗糙度和成分分析。所有循环都在25 mA/cm2的电流密度下在全电池上进行。(A)在锌或锌铜电解质中进行1600次循环后的锌负极的表面形态。负极作为循环和电解质功能的(B)x射线衍射模式。(C)Zn的不同晶体取向。(D到G)负极表面在不同的电解质中循环后的负极表面的扫描电镜图像。
通过研究Zn/Zn2+参比电极在沉积和剥离过程中负极电位的变化,揭示了两种电解质中锌的成核和晶粒生长机理。图3a中的例子表明,在电流密度为25 mA/cm2的情况下,镀锌需要一个高达−0.2V的过电位。在仅锌电解质中,随着电流的施加,电位从−0.1快速跳转到−0.2V,然后电位变化比较小,在25s的时间内低于20 mV。电位的突然初始增加与形成锌团簇的成核步骤有关。随后的电位变化被称为平台过电位,与已经存在的核生长有关。由于平台过电位相对于成核时较小,这一观察根据结果得出,在已存在的原子核中加入锌比形成新的团簇更有利,能垒更低。
在Zn-Cu电解质中,施加沉积电流后,负极电位最初为0.2 V,在前5s内下降到−0.03V。这种变化归因于还原铜离子的过程。随着沉积过程的进行,电位逐渐从−0.03转移到−0.115V,导致~为75mV的平台过电位。电位相对较大的变化表明,Zn-Cu电解质中额外的锌沉积涉及成核和生长,而锌生长对成核的偏好不像仅锌电解质中那样明显。
电沉积锌团簇的半径可以通过成核的吉布斯自由能方程来估计:ΔGnucleation=−(4/3)πr3ΔGV + 4πr2ϒ,式中,r为球形核的半径,ΔGV为每体积的自由能变化,ϒ为电解质与负极之间的表面能。当体自由能(−4/3πr3ΔGV)等于表面自由能(4πr2ϒ)时,假设团簇的半径处于平衡点。沉积过电位η与=Fη/Vm的ΔGV有关,其中F为法拉第常数,Vm为锌的摩尔体积(Vm=9.157×10−6m3/mol)。求解ΔGnucleation=为0时的簇半径r,表达式变为:
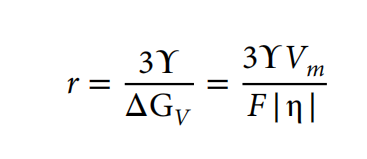
该表达式显示了簇半径和过电势之间的负相关关系。如图3B所示,Zn-Cu电解质中负极的平台过电位高于锌电解质,而Zn-Cu体系中的表面能略低。根据补充说明计算,Zn-Cu电解质中团簇半径为1.63nm,仅锌电解质中团簇半径为12.1nm。与大的原子核相比,Zn-Cu电解质中较小的团簇半径有利于更均匀的平面覆盖,因此导致垂直的枝晶生长,如图3f所示。
为了检查每个电解液中锌负极的可逆性,测试了图3c中的锌/锌对称电池,结果显示达到了0.42和0.84 mAh/cm2的截止容量。通过将Zn-Cu电解质中的Cu浓度从0.1M增加到0.2M,能够得到更高的截止容量。在图3(D和E)中,只有锌电解质的电池在36和62小时后短路。同时,含Zn-Cu电解质的对称电池在90小时内保持,~1000循环后过电位发生明显的变化。因此,与仅含锌的电解质相比,Zn-Cu电解质在不同的截止容量下促进了更好的循环稳定性。
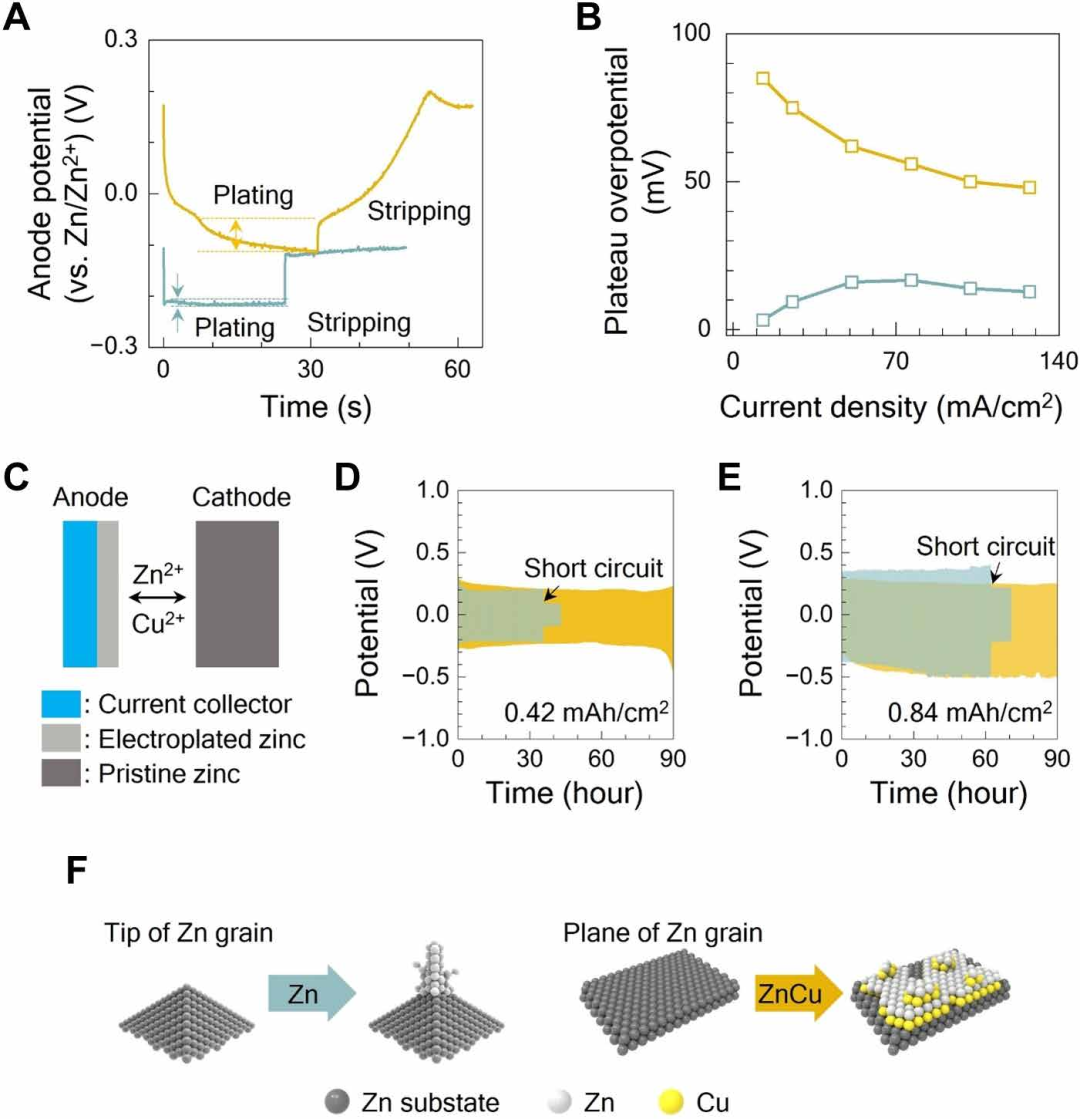
图3. 电解质对负极电位的影响。蓝色,仅含锌的电解质;橙色,Zn-Cu电解液。(A)在电流密度为25 mA/cm2时,用三电极结构测量的负极电位变化。平台过电位用箭头标记。(B)Zn-Cu和仅锌电解质中锌负极的平台过电位随充电电流密度的函数。(C)锌/锌对称电池的器件结构。在Zn-Cu电解质中,在电流密度为(D) 0.42和(E) 0.84 mAh/cm2的Zn/Zn对称电池下的电位变化。电池在Zn电解质中短路,但在Zn-Cu电解质中继续循环。(F)负极表面Zn和CuZn的晶粒生长机理示意图。
图4显示了仅使用Zn(蓝色曲线)和Zn-Cu(橙色曲线)电解质的ZICs的电化学性能。从图4(A和C)能够准确的看出,Zn-Cu器件的循环伏安电流-电压特性表现出更方形的形状,使得Zn-Cu的1.6F和1.4F的电容分别提高了14%。在图4(B和D)中,电流密度≥为22.5mA/cm2时的循环多个方面数据显示时间更长放电时间,因此Zn-Cu电容器的容量高于仅Zn器件。在电流密度为7.5mA/cm2时,两种电容器的放电时间相似,而Zn-Cu电容器在放电开始时的电压降较小。在图4e中得到了电化学阻抗测量,进一步支持了这一观察结果,其中Zn-Cu电池的等效串联电阻(ESR)比单独的Zn低3倍。将电容器充电到2V后,测量图4f中的自放电(43)特性,每0.1s采样一次开路电压一次。由于电极是用相同的材料和负载制造的,自放电的差异归因于电解质的影响。下降0.6V的Zn-Cu器件的电压衰减略小,而仅Zn器件的电压衰减下降0.5 V。锌铜电解质中自放电率较高的原因是锌离子与铜离子之间的自发反应。由于铜离子具有更高的标准电池电位,氧化锌对铜离子的还原是自发发生的。因此,部分锌电极被剥离,并表现为电压的衰减,然而,铜离子与锌电极的反应在10小时后达到平衡,因为负极表面铜浓度的增加改变了表面氧化还原电位,稳定了负极,阻止了进一步的电解质反应,如图4f中电池电压平台所示。
Zn-Cu和仅Zn电容器的面积能量和功率密度汇总见图4g。在低功率但在大功率充放电时,ESR改进的Zn-Cu电池保持了更好的单位体积内的包含的能量。
活性材料在正极和负极上的负载它们的容量应相匹配,以避免未使用的材料,并最大限度地提高单位体积内的包含的能量。然而,对于氧化硅,负极通常包含比正极更多的容量。在这项工作中,我们缓解了这种不平衡,并通过增加正极上单位面积活性炭的负载来缓解这种不平衡,并将n/p比值降低到3.10。n/p比和累积容量的计算在方法中定义。理想的n/p比值是1,以最大限度地提高正极和负极的平衡。如图4G所示,当功率密度为22mW/cm2时,当n/p比为3.10时,单位体积内的包含的能量提高到0.74mWh/cm2,而当n/p比为5.93时,能量密度为0.34mWh/cm2。通过提高n/p比值,面积容量增加了一倍。
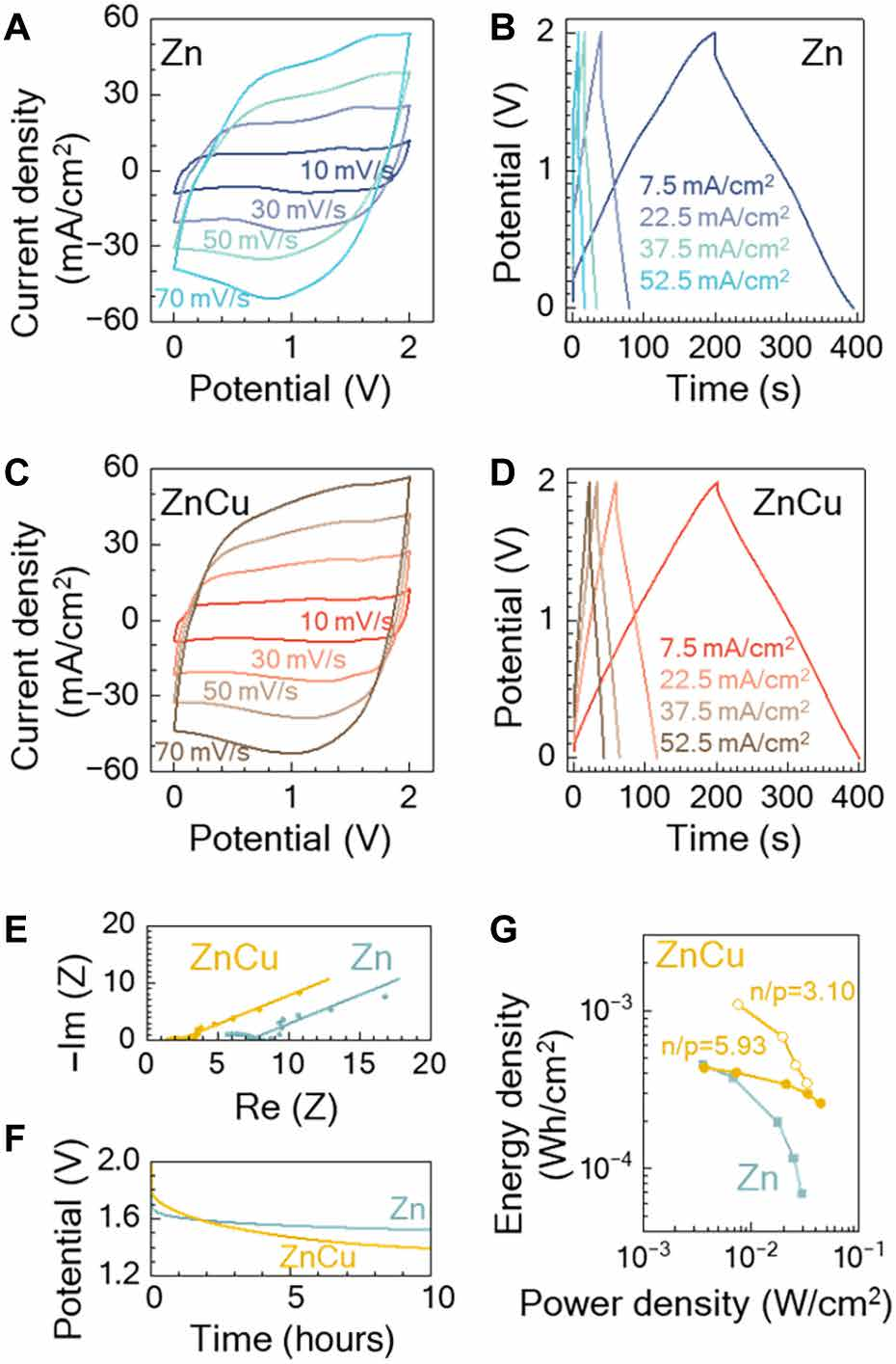
图4. 不同电解质作用下锌的性能比较。(A) Zn和(C)Zn-Cu电解质在10~70mV/s的扫描速率下测量循环伏安法。在7.5~52.5mA/cm2的电流密度下,用(B) Zn和(D)Zn-Cu电解质进行循环测试。(E)在0.01 Hz至100 kHz频率范围内的不同电解质中的电容器的奈奎斯特图。(F)在充电到2V并设置到开路状态后,两个具有不一样电解质的电池的电位衰减。(G)使用Zn或Zn-Cu电解液的电容器的单位体积内的包含的能量与功率密度。
虽然较小的n/p比值增强了单位体积内的包含的能量,但观察到它循环稳定性的平衡。图5A显示了容量保留作为n/p比率的函数。对于n/p比为5.93的电容器,Zn-Cu电解质抑制了枝晶的形成,电池在25000次循环后保持其90%的原始容量。然而,在n/p比值为3.10时,电池容量保留率下降到6700个周期的90%以下。这种随着n/p比值的降低而降解,部分原因是由于电解质中铜离子的耗尽,导致枝晶的重新出现,因此导致短路。
从图5B能够准确的看出,通过调整电解质中的铜离子浓度(n/p比为5.93,n/p比为3.10时为0.2M),提高了Zn-Cu电容器的循环寿命和累积容量。我们注意到在不同的n/p比下,铜离子的最佳浓度,随着n/p比的降低,随着电池放电,更多的锌离子溶解到电解质中;因此,锌的浓度增加。为了配合Zn离子,随着n/p比值的降低而增加,应增加Cu离子的浓度,为ZnCu合金的形成提供足够的Cu。然而,当铜离子浓度增加到0.2 M以上时,负极铜自发还原的大程度干扰了沉积锌和剥离过程,因此,我们将电解液中最大铜离子浓度保持在0.2M。
累积容量与n/p比值一般呈相似的趋势,如图5c所示,但负极在过剩的n/p比率=55.6下,这在某种程度上预示着相当一部负极仍未使用,最终不会促进能量储存。对于更平衡的n/p比率为3.88,报告的累积容量低于3.2Ah/cm2,CuZn4合金衬底,常规使用的寿命为~7000循环(250小时)。在本研究中,通过用Zn-Cu电解质补充CuZn合金,累积容量超过了之前的最先进记录,在n/p比=5.93时达到7.4Ah/cm2,在n/p=3.10时达到4.7Ah/cm2,循环寿命分别为22,000个循环(相当于557小时)和6700个循环(347小时)。
将用Zn-Cu电解质制备的锌电容器与锂和钠电容器的单位体积内的包含的能量和功率密度进行了比较,如图5d所示。在功率密度为300W/kg时,当n/p比为5.93时,电池的单位体积内的包含的能量为41Wh/kg。该单位体积内的包含的能量是根据活性物质,即锌和活性炭之和计算出来的。当包括集电器和分离器组件的重量时,单位体积内的包含的能量为14.9Wh/kg,小于商业化的水平(>
40Wh/kg)。虽然锌离子电容器的单位体积内的包含的能量低于锂和钠,但锌离子电容器的功率密度优越,达到3.5kW/kg。此外,锌离子电容器的累积容量远高于锂离子和钠离子电容器,提高了2-18倍,如图5e所示。因为适当的电解质抑制枝晶形成,使得锌离子电容器拥有非常良好的循环稳定性。
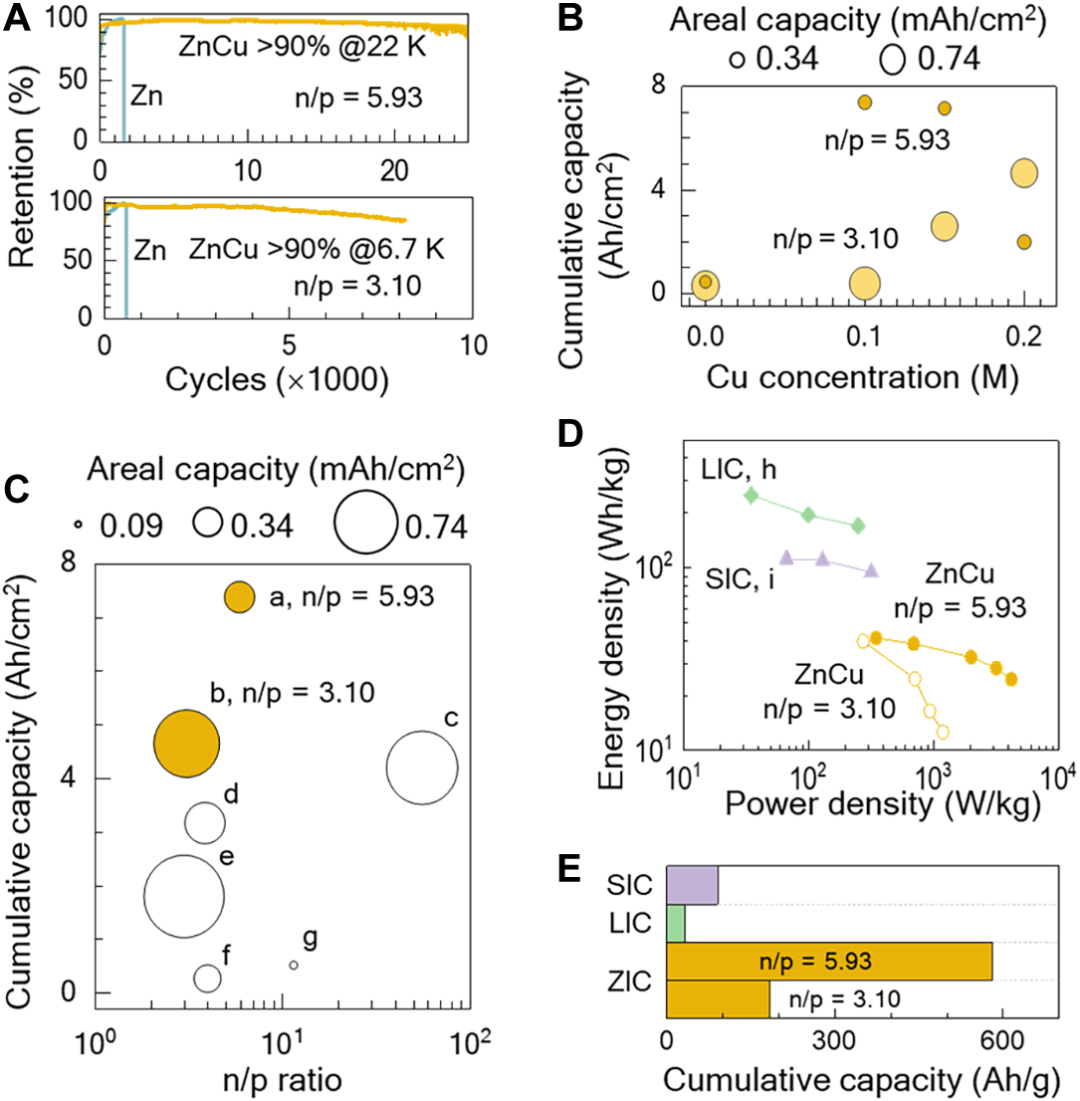
图5. 金属离子电容器对循环稳定性和累积容量的比较。在25mA/cm2的电流密度下,在0~2V之间进行循环。(A)不同n/p比电池的仅锌或Zn-Cu电解液的容量保留。(B)累积容量作为ZnCu电解液中铜离子浓度的函数。(C)累积容量作为n/p比率的函数。(D)金属离子电容器的单位体积内的包含的能量和功率密度:锂(LIC)、钠(SIC)和锌与Zn-Cu电解质。(E)金属离子电容器的累积容量。
总之,这项工作证明了一种简单的方法,利用促进CuZn合金沉积的电解质来抑制循环过程中的枝晶,可以明显提高ZICs的循环寿命和单位体积内的包含的能量。对成核生长平台阶段晶粒取向和过电位的表征表明了Zn-Cu电解质下平面生长的能量势垒降低,阐明其增强循环稳定性的机制。当电池n/p比值为3.10的ZICs显示出41Wh/kg的高单位体积内的包含的能量,能够持续6700次循环,容量降至90%以下可循环347小时。本研究中的Zn-Cu电解质是一种高性能、低维护的电化学能源供应方法。
原文标题:加利福尼亚大学圣地亚哥分校Tse Nga Ng团队Sci. Adv:双离子Zn-Cu电解质,提升锌离子电容器(ZICs)单位体积内的包含的能量
上一篇:剖析电路图中电容电阻的效果
下一篇:电容基本知识科普:主要参数和分类
